Y en el año 2022 comenzamos, lentamente, a recuperar una cierta normalidad después de todo lo vivido en los 2 últimos años. Y aunque no por completo, pues no deja de sobrevolarnos la recurrente amenaza, en no pocas ocasiones bastardamente alimentada, de las nuevas apocalípticas y destructivas olas. Ahora, es tiempo de parar y dedicar unos minutos – porque realmente lo merece – a conocer y reconocer como se merecen, las aportaciones que los oncólogos radioterápicos españoles hemos hecho este pasado 2022. Y, desde esta tribuna y puesto en pie, vaya mi reconocimiento y homenaje a todos los oncólogos radioterápicos españoles que, además de su dedicación asistencial, encuentran tiempo, ganas y valor para dedicar parte de su esfuerzo a difundir y publicar su trabajo contribuyendo al avance de la Medicina en global y de la Radioterapia en particular.
Antes de seguir y entrar a fondo, un recordatorio: no es la intención de esta entrada (ni la de su autor), y nunca lo ha sido, revisar todo tipo de publicaciones aparecidas en revistas, libros o similares, todo tipo de ponencias y comunicaciones en cursos, jornadas, seminarios o reuniones, ¡qué las hay y muchas!, sino que tan sólo se busca reflejar la producción científica de los oncólogos radioterápicos españoles empleando para ello, aunque no exclusivamente, publicaciones incluidas en una base de datos de reconocido prestigio como PubMed – y en las revistas recogidas por la misma – por lo que es posible que publicaciones no incluidas en este índice concreto hayan sido omitidas. Igualmente, reiterar que la selección y gradación final de los 15 artículos más relevantes es absolutamente subjetiva, guiada exclusivamente por el criterio particular del autor de la entrada. Ni el tamaño del estudio, ni el prestigio en forma de factor de impacto de la publicación que aloja el trabajo, ni la autoría intelectual del mismo, han sido condicionantes para elaborar esta lista y no es su objetivo – ni primario ni secundario – establecer clasificación competitiva alguna más allá de lo compleja y retorcida que pueda parecer en ocasiones la particular opinión de quién elabora anualmente esta entrada.
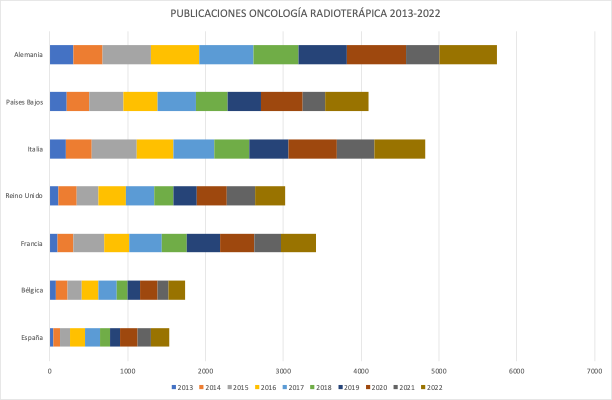
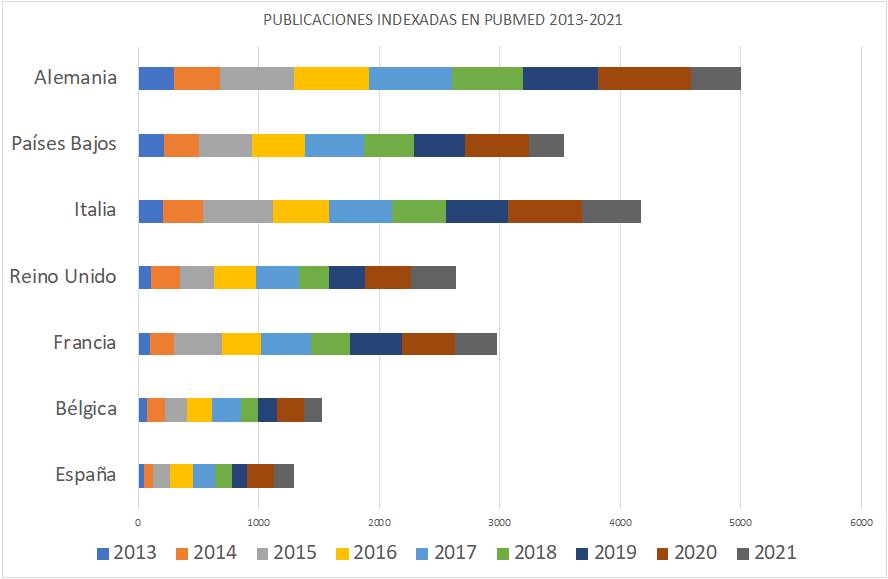
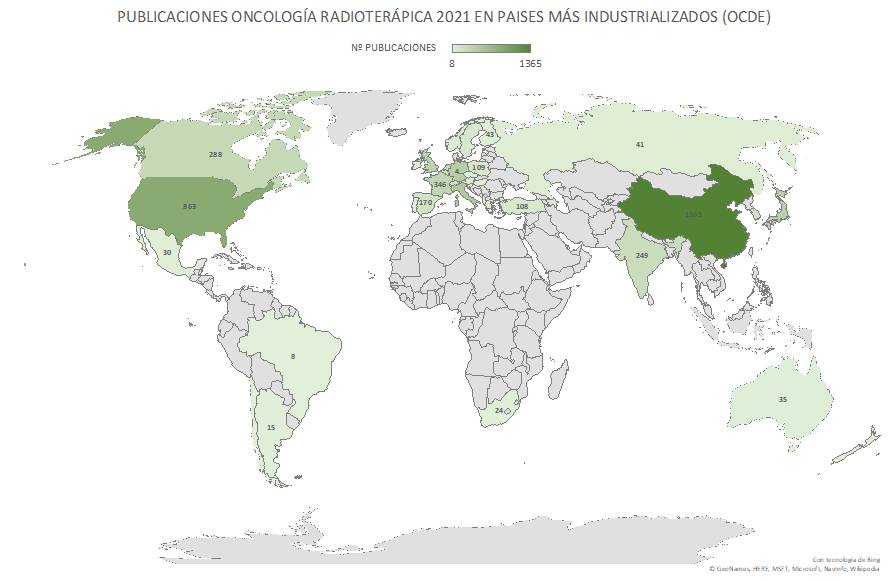
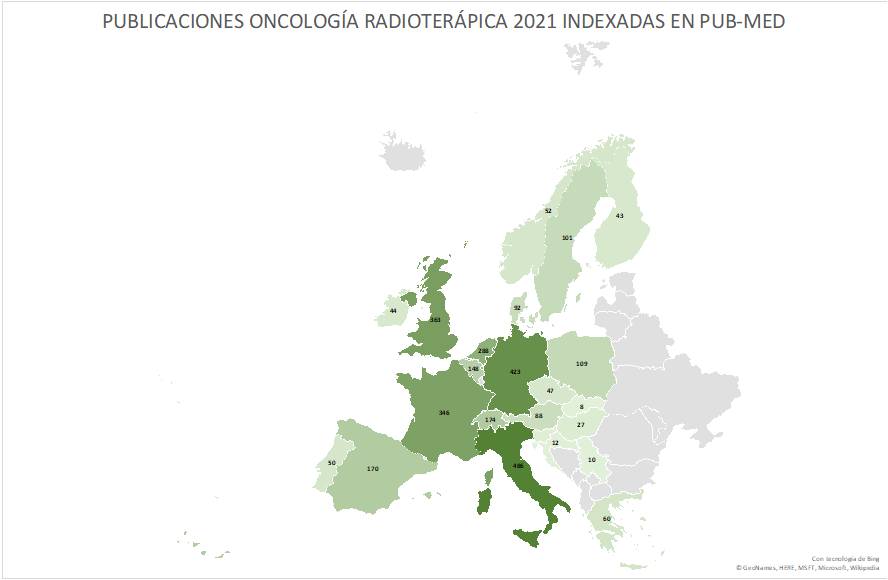
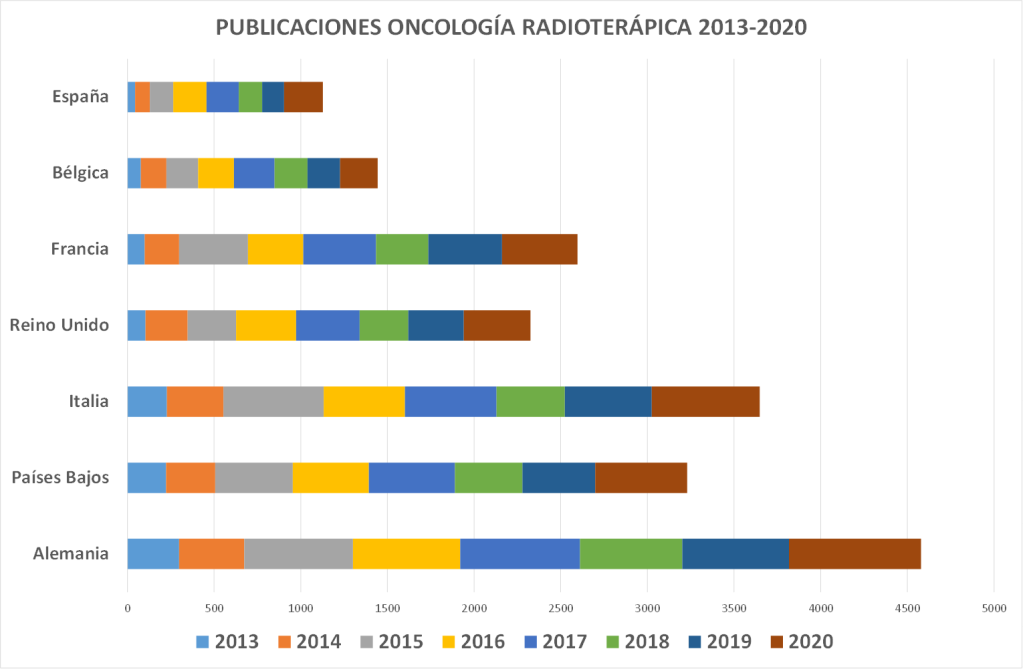
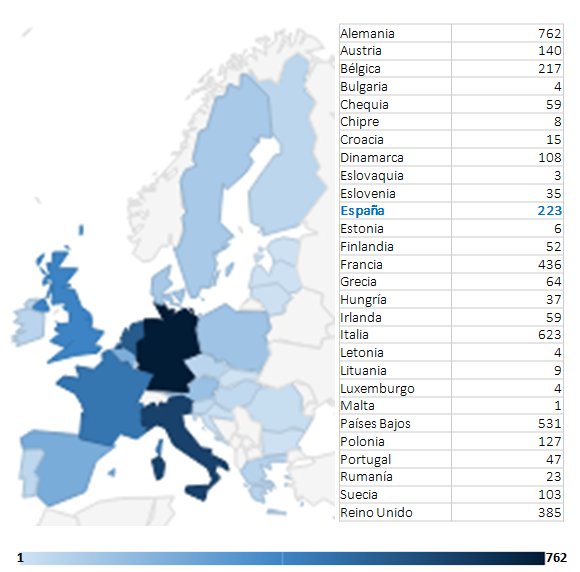
Las 235 publicaciones de los Oncólogos Radioterápicos españoles en 2022 (listado completo aquí) suponen un ascenso notable con respecto las registradas en pasados años. Quizás el aumento de publicaciones indexadas en las bases de datos que amplían las opciones de presentar y comunicar trabajos y resultados puedan, en parte, explicar este aumento. Pero también la creciente y constante incorporación de jóvenes oncólogos radioterápicos excelentemente formados en los últimos años, que refleja la solidez y seriedad de la docencia post-grado en Oncología Radioterápica en toda España, contribuye en gran medida a explicar este renovado interés en salir del bunker y exponer y defender los avances de la investigación en radioterapia en nuestro país. Aún así, los números no deben empañar la realidad de la Oncología Radioterápica en España. Un sistema de salud, mayoritariamente público con todo lo que ello supone, centrado (casi) exclusivamente en la labor asistencial, y que desprecia – sistemáticamente – la investigación y la docencia, a las que no confiere valor, y que sigue rigiéndose por la «añocracia» como patrón oro para determinar ascensos y promociones. Pero también una especialidad a la que lastra, en nuestro país, una dificultad mayúscula para encontrar financiación para la investigación, y que tan sólo ha conseguido actualizarse tecnológicamente gracias a una donación privada de la Fundación Amancio Ortega, así como los costes exigidos para la publicación por cada vez más revistas, que en demasiadas ocasiones se subsanan gracias al bolsillo particular de los propios investigadores, convierte la publicación en Oncología Radioterápica en el mejor exponente del unamuniano lema “que inventen [investiguen] ellos”. Algo que explica bastante bien por qué España no figura habitualmente entre los países que lideran la producción científica mundial., tanto en la UE como en lo que refiere a los países más industrializados de la OCDE.
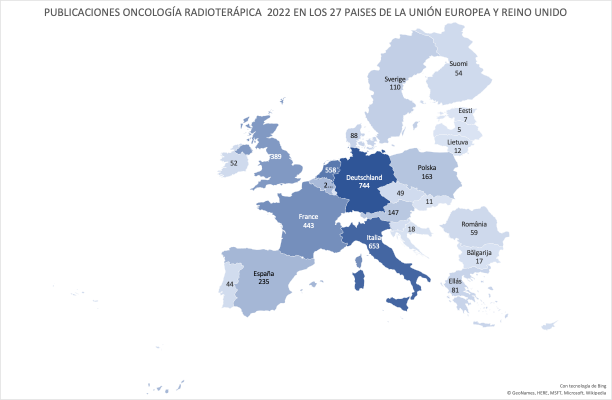
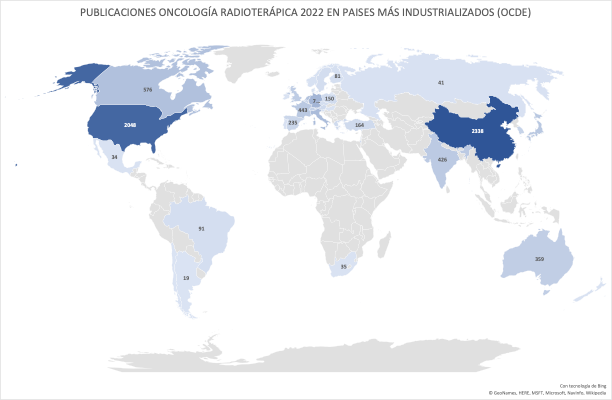
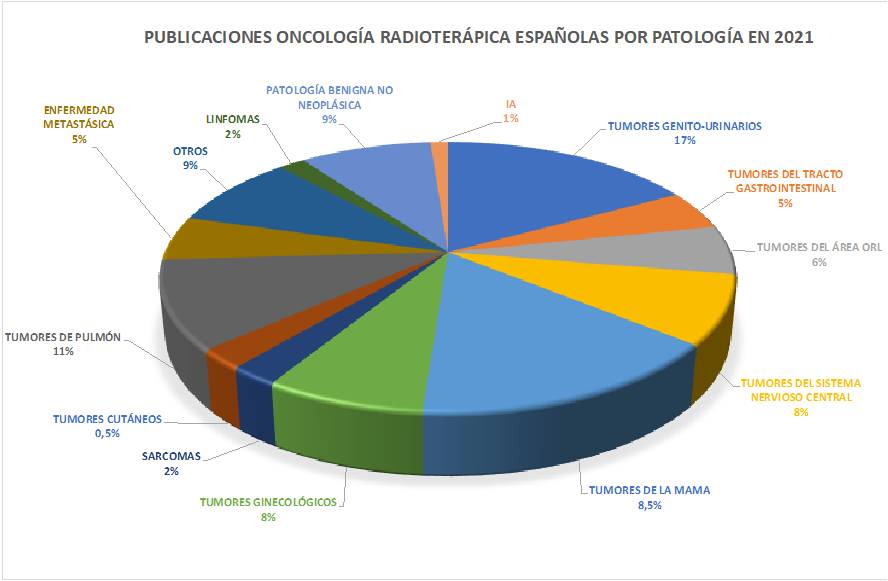
En este pasado 2022, y en línea coincidente con años previos, las áreas de interés donde se concentran la mayoría de las publicaciones de autores españoles han sido los tumores genitourinarios en primer lugar, seguidos, de pulmón y mama. Merece la pena destacar también la presencia cada vez mayor e trabajos que inciden sobre las enormes posibilidades que la inteligencia artificial tiene para la oncología radioterápica, y cuyo desarrollo estamos ya experimentando.

Las siguientes 15 publicaciones son, en orden creciente de importancia, las que a mi juicio mayor impacto han tenido en este pasado año 2021. Como ha quedado previamente dicho, se trata una apreciación subjetiva y se podrá echar en falta algún artículo concreto o cuestionar el orden y gradación establecidos, pero la mayoría de los artículos mencionados merecen estarlo y son un fiel reflejo de la actividad científica de la Oncología Radioterápica en España:
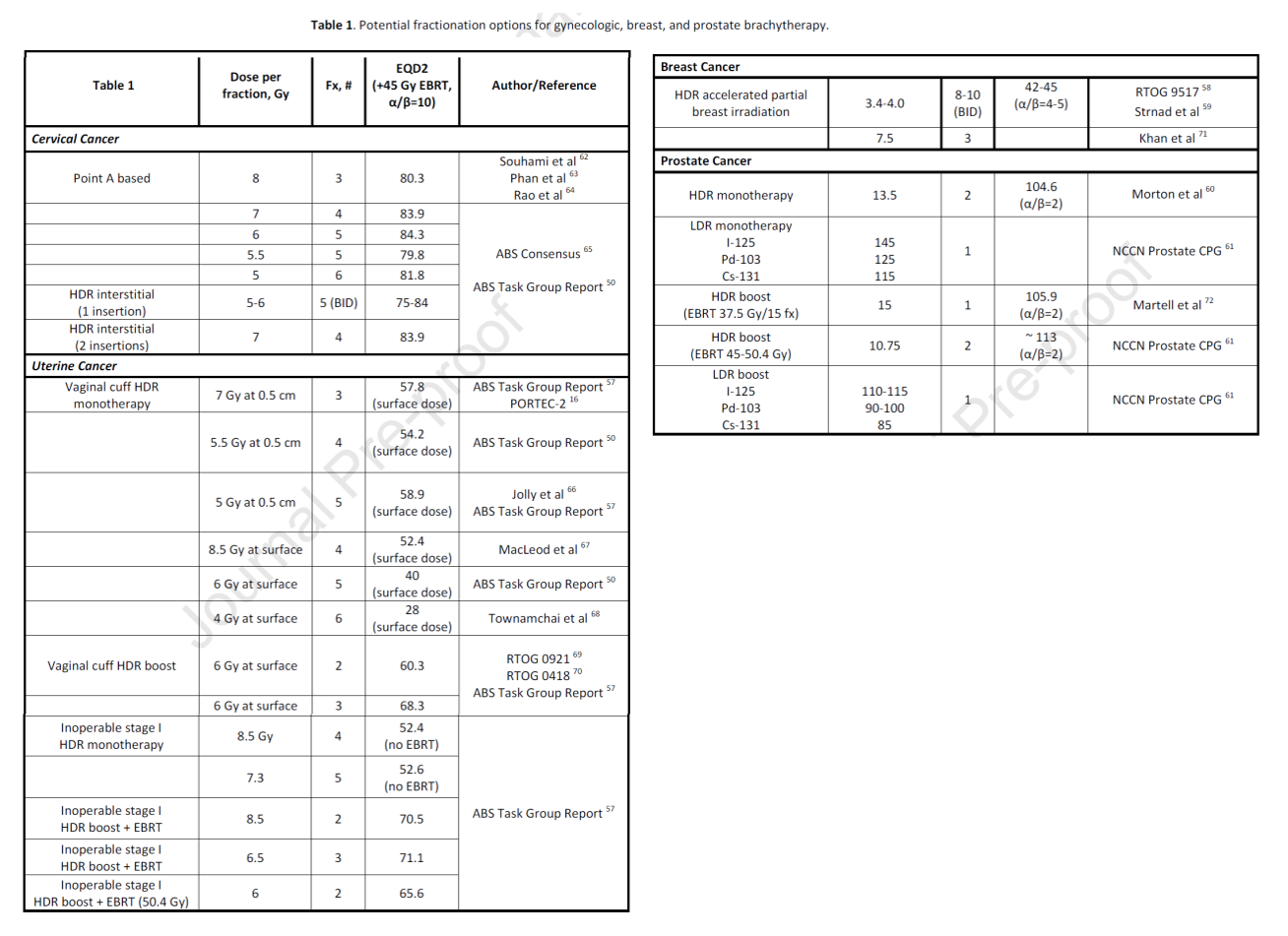
Este trabajo recoge las recomendaciones del Grupo de Braquiterapia de la Sociedad Española de Oncología Radioterápica (SEOR) y la Sociedad Española de Física Médica (SEFM) acerca del empleo de braquiterapia intersticial de alta tasa de dosis (HDR) en neoplasias ginecológicas. Una encuesta de 9 preguntas realizada en 2021 acerca de la experiencia con la BT intersticial, las indicaciones y la técnica, el tipo de aplicador, la planificación basada en resonancia magnética, la dosis, el programa de fraccionamiento y la planificación del tratamiento entre los 72 centros de Oncología Radioterápica españoles que disponen de braquiterapia, de los cuales respondieron el 50%, ha servido como herramienta para la elaboración de estas recomendaciones, junto a la revisión de la literatura disponible y la experiencia profesional del grupo de expertos. En base a ello, los autores establecen una serie de recomendaciones sobre indicaciones, contraindicaciones, selección de pacientes, descripción de aplicadores, papel de la imagen en la planificación, prescripción de dosis y planificación dosimétrica para cánceres de cuello uterino, vagina y vulva que son de enorme utilidad para todos los profesionales involucrados en la atención y tratamiento de los tumores ginecológicos.
Similar al artículo previo, también se han publicado este pasado 2022 recomendaciones del grupo de SBRT de la Sociedad Española de Oncología Radioterápica (SEOR) para el empleo de radioterapia estereotáctica corporal (SBRT) para tratar las metástasis óseas no vertebrales y maximizar las ventajas que esta técnica aporta en control del dolor y control local de la enfermedad.
Los autores de este trabajo se centran en un aspecto emergente, pero de enorme potencial de desarrollo, para la radioterapia como es el abordaje de los tumores renales. Tumores estos en los que, tradicionalmente, el tratamiento de elección ha sido la cirugía. Sin embargo, los autores proponen una acertada reflexión acerca del tratamiento más adecuado en aquellos pacientes que no sean candidatos a tratamiento quirúrgico o que rechazan el mismo, y plantean la alternativa de la radioterapia, apoyada en los avances tanto tecnológicos – con el crecimiento imparable de la irradiación ablativa esterotáxica (SABR) – como en los avances en el conocimiento del comportamiento biológico de estos tumores y su respuesta a la nueva inmunoterapia y las posibilidades que la adecuada combinación de ambas estrategias puede proporcionar como una alternativa viable, segura y eficaz para el tratamiento de los tumores renales.
Si complicada es la investigación clínica en oncología radioterápica en nuestro país, ¡qué decir de la investigación básica! Éste, y algún otro trabajo también aquí incluido, reflejan el esfuerzo y dedicación de muchos investigadores para aportar su contribución al desarrollo de la oncología y la radioterapia. Los autores de este artículo publican los resultados de su trabajo sobre los sistemas antioxidantes y los procesos inflamatorios relacionados con la aparición y el desarrollo del cáncer de mama y el papel que juegan en la resistencia a los tratamientos. Basándose en un análisis retrospectivo en muestras de sangre de 237 mujeres con cáncer de mama antes y después de la radioterapia, y empleando el algoritmo Gradient Boosting Machine (GBM) para identificar variables predictivas, los autores identificaron los niveles de neutrófilos, los leucocitos totales, los eosinófilos, el colesterol de lipoproteínas de muy baja densidad y la actividad de PON1 como potenciales factores predictores de muerte por cáncer de mama.
Los autores de este trabajo analizan de manera prospectiva la eficacia de la combinación de técnicas ablativas de radioterapia de alta precisión (SABR) y de la inmunoterapia específica con anti-PD1 (pembrolizumab, nivolumab) en 50 pacientes con carcinoma de pulmón no microcítico metastásico o melanoma metastásico. Con una mediana de seguimiento de 33 meses, la tasa de respuesta objetiva fue del 42% (30% respuestas completas y 12% respuestas parciales), la mediana de supervivencia libre de progresión fue de 14,2 meses y la mediana de supervivencia global desde la SABR fue de 37,4 meses. Además, los autores observaron la presencia de respuesta de otras lesiones metastásicas alejadas del área irradiada (efecto abscopal) hasta en un 65%, de los 40 pacientes en los que pudo evaluarse. La conclusión de los autores es que la combinación de anti-PD-1 y SABR puede alcanzar altas tasas de respuesta y ampliar el beneficio clínico de la inmunoterapia al retrasar la progresión y la necesidad de una nueva terapia sistémica.
La administración de la radioterapia durante el acto quirúrgico, radioterapia intraoperatoria (RIO), constituye una alternativa consolidad para el tratamiento de la enfermedad tumoral oligorecurrente. Establecer la mejor secuencia así como la posible combinación de distintas estrategias terapéuticas suponen retos para el manejo de aquellos pacientes en los que el tumor reaparece, en muchas ocasiones como única localización tumoral, en un área previamente irradiada. Los autores de este trabajo, con amplia experiencia en RIO de múltiples localizaciones, presentan los resultados observados combinado una estrategia de RIO que se complementó con la administración postoperatoria de protonterapia, en pacientes con oligorecurrencia tumoral. Los autores sostienen la factibilidad y seguridad de este abordaje y discuten las prometedoras opciones que para el futuro se abren en estos casos y con la tecnología de irradiación FLASH que se está desarrollando actualmente.
La Inteligencia Artificial (IA) es ya una realidad en la que, guste o no, va a transitar todo el devenir futuro. Y la Medicina no es una excepción. Antes bien, es uno de los ámbitos dónde la IA muestra más precozmente su inmenso potencial. La radiómica o el aprendizaje de las máquinas (machine learning) son sólo 2 de las aplicaciones más inmediatas de la IA en Oncología y, más concretamente, en la Oncología Radioterápica y que. Están llamados a cambiar – ¡ya lo están haciendo! – nuestra manera de entender la práctica clínica diaria. La radiómica, basada en el análisis complejo y profundo de la información aportada por las técnicas de imagen, está cambiando el mundo de la medicina y, más concretamente, el de la oncología, y supone uno de los grandes avances cuyo potencial hemos apenas empezado a intuir. La autora de este magnífico artículo revisa en profundidad la utilidad de la radiómica para el diagnóstico precoz y diferencial de lesiones benignas y malignas en páncreas, para la evaluación de la respuesta y el riesgo de recurrencia, supervivencia y pronóstico de la enfermedad y la relación que estos hallazgos basados en parámetros radiológicos tienen con la respuesta a la radioterapia y la quimioterapia en cáncer de páncreas y su impacto sobre el resultado final del tratamiento.
En este segundo artículo sobre el impacto que la IA va a atener, está ya teniendo, en la práctica clínica diaria, los autores analizan la importancia de las técnicas de autoaprendizaje computacional. En este artículo los autores muestran como la utilización de herramientas de IA permite diseñar y evaluar un modelo para la planificación automatizada de los tratamientos que permite generar de forma eficiente planes de irradiación craneal con protección del hipocampo y que sean clínicamente aceptables en pacientes con cáncer de pulmón microcítico que precisen de irradiación craneal profiláctica (ICP). Los autores emplean datos obtenidos de 44 pacientes en los cuales se realizó ICP y de las planificaciones realizadas para genera un modelo basado en el conocimiento de planificación automática. Posteriormente, la calidad del modelo generado se evaluó en otros 10 pacientes no analizados con anterioridad, pudiendo los autores conformar una reducción del tiempo de planificación a menos de la mitad el tiempo que una mejoría en los índices de homogeneidad alcanzados. La conclusión de los autores es que las herramientas de IA que permiten la automatización de los procesos de planificación en radioterapia pueden mejorar la eficiencia, la seguridad y la calidad de los tratamientos.
La radioterapia intraoperatoria (RIO) ha experimentado un renovado interés en España, en gran parte gracias a la donación de la Fundación Amancio Ortega que ha permitido la adquisición de equipos de RIO y, más particularmente, de equipos de kilovoltaje. En este estudio, que ha incluido investigadores de de centros de Perú, Alemania y España, se ha analizado la RIO con kilovoltaje como medio de administrar la sobredosificación del lecho tumoral en pacientes con cáncer de mama que precisan de radioterapia adyuvante. Los autores recogen la experiencia en 653 pacientes con una mediana de seguimiento de 55 meses a los que se administró una dosis mediana de RIO de 20 Gy sobre el lecho tumoral tras la tumorectomía y posterior radioterapia externa. Las tasas de recaída local acumulada a los 12, 60 y 120 meses fueron del 0,3%, 2,3% y 7,9%, respectivamente. Tras el análisis multivariante, sólo la edad <50 años siguió siendo un factor pronóstico significativo para la recidiva local. La conclusión de los autores es que la sobredosificación con RIO es factible y segura en cáncer de mama.
En este artículo de opinión, de obligada lectura para todos aquellos interesados en el tratamiento del cáncer de próstata, los autores exponen de manera clara, sucinta y contundente las razones y evidencias que justifican considerar la braquiterapia como una herramienta de enorme utilidad en el manejo multidisciplinar de los pacientes. La combinación de braquiterapia y radioterapia externa, con o sin tratamiento hormonal, ha demostrado ser una excelente opción de tratamiento para hombres con cáncer de próstata de riesgo intermedio y alto. Los resultados en control bioquímico, la supervivencia sin metástasis, la supervivencia por causa específica y, en última instancia, la curación, son muy positivos, y así lo avala y certifica la numerosa evidencia publicada. Sin embargo, a continuación Martin y Spratt defienden un punto de vista contrario y desgranan como los últimos avances y evidencias de la radioterapia en cáncer de próstata no sustentan la necesidad de la braquiterapia en todos los casos de adenocarcinoma de próstata de riesgo intermedio o alto. Ambas opiniones conforman una visión amplia de la realidad del tratamiento moderno en estos casos y como la discusión individualizada de cada situación y. una adecuada valoración de pros y contras es imprescindible en la práctica diaria de la oncología.
Al igual que lo sucedido en 2020 y 2021, la Oncología Radioterápica española se ha situado en la vanguardia que demostró la eficacia de la irradiación pulmonar bilateral a bajas dosis frente a la neumonía por COVID-19 y que supuso una alternativa terapéutica en un momento en el cual se carecía de medidas eficaces. En nuestro país, al neos 3 grupos analizaron la eficacia de esta aproximación. En este trabajo, los autores presentan los resultados de un ensayo prospectivo de fase I-II en el que se incluyeron 41 pacientes con COVID-19 con una mediana de edad, de 71 años con afectación pulmonar bilateral en el estudio de imagen y necesidad de oxígeno (saturación de oxígeno ≤93% con aire ambiente). Los pacientes recibieron 1 Gy en todo el pulmón en una sola fracción. El objetivo primario era evaluar la respuesta radiológica en los días +3 y +7. Los autores observaron una mejora significativa de los parámetros radiológicos y de los niveles de oxigenación de acuerdo con la determinación de SAFI en los días +3 y +7, así como una disminución de los niveles de proteína C reactiva y del recuento linfocitario sin observarse toxicidad atribuible al tratamiento. La conclusión de los autores es que la irradiación pulmonar a dosis bajas es segura y eficaz en pacientes con neumonía COVID-19, y si bien esta ahora parece más controlada, es una opción a tener en cuenta ante la eventualidad de otros cuadros similares en años venideros.
El ensayo DART 01/05 es una de las mejores muestras del valor de la investigación clínica en Oncología Radioterápica en España, y demuestra el potencial de los investigadores patrios para la misma. Este estudio multicéntrico y aleatorizado, que ya ha presentado resultados en sesiones plenarias y presidenciales de congresos internacionales de primer nivel, y cuyos resultados iniciales se han publicado en revistas de alto impacto, se diseñó para determinar si la deprivación androgénica a largo plazo es superior a la deprivación androgénica a corto plazo cuando se combina con radioterapia a dosis altas. Los resultados a 5 años mostraron que 2 años de deprivación androgénica adyuvante combinada con radioterapia a dosis altas mejoraba significativamente el control bioquímico, la supervivencia libre de metástasis y la supervivencia global, especialmente en pacientes con enfermedad de alto riesgo. En este artículo, los autores presentan los resultados finales a 10 años del ensayo. Con una mediana de seguimiento de 119,4 meses, los autores no pudieron confirmar el beneficio significativo del tratamiento hormonal prolongado que se observó a los 5 años, si bien el beneficio fue siempre mayor en los paciente s con tumores de alto riesgo a diferencia de los pacientes con tumores de riesgo intermedio.
La eficacia de las firmas genéticas para predecir el comportamiento de distintos tumores, y su respuesta a diferentes tratamientos, es una realidad consolidad en muchos tipos de cáncer. Y constituyen una herramienta de enorme utilidad para el oncólogo. El cáncer de pulmón no microcítico (CPNM) es la principal causa de muerte por cáncer en todo el mundo, generando un enorme impacto económico y social que no ha dejado de crecer en los últimos años. El tratamiento incluye la combinación de distintas estrategias; cirugía, radioterapia, quimioterapia o inmunoterapia, aunque la existencia de perfiles moleculares ampliamente heterogéneos explica las diferencias observadas en los resultados entre distintos pacientes. El objetivo de los autores ha sido identificar firmas génicas pronósticas y predictivas de respuesta a la radioterapia, que pudieran ayudar en la toma de decisiones terapéuticas en pacientes con cáncer de pulmón no microicítico. A través del estudio en líneas celulares, y extrapolando las diferenciadas en el perfil de respuesta a la radiación ionizante (líneas radiosensibles frente a radioresistentes) a una cohorte de 107 pacientes que habían recibido radioterapia se obtuvo una firma de seis genes (APOBEC3B, GOLM1, FAM117A, KCNQ1OT1, PCDHB2 y USP43) con capacidad para predecir la supervivencia global y la supervivencia libre de progresión, lo que podría traducirse en una predicción de la respuesta al tratamiento oncológico recibido. Los pacientes que presentaban una firma pronóstica desfavorable tenían una mediana de supervivencia global de 24,13 meses frente a 71,47 meses para los que presentaban una firma favorable, y la mediana de supervivencia libre de progresión era de 12,65 meses frente a 47,11 meses, respectivamente.
La eficacia y seguridad de la irradiación a dosis bajas para los trastornos osteoarticulares degenerativos e inflamatorios no admite duda. Cada vez es mayor el número de profesionales que, vendiendo atávicos complejos y prejuicios, apuestan por emplear un tratamiento fiable, eficaz (y barato) para el alivio sintomático de muchos trastornos que, de otra manera, condenan a sus padecientes a una merma muy notable en su calidad de vida. En este artículo los autores, que acreditan una de las mayores experiencias en el empleo de estos tratamientos, publican los resultados de la serie más amplia nunca previamente publicada de pacientes con trocanteritis sintomática refractaria a otros tratamientos y que recibieron radioterapia a dosis bajas con intención antiinflamatoria. Un total de 155 pacientes, con una edad media de 69 años, y un una media de dolor secundario a trocanteritis medida de acuerdo a la escala EVA previa al tratamiento de 8, recibieron una dosis de 6-10 Gy (1 Gy/día/3 fracciones por semana en días alternos). El dolor, medido de acuerdo a la escala EVA, se redujo a una media de 5 al mes del tratamiento y de 4 a los 4 meses. En el 56% de los pacientes se observó una respuesta objetiva a los síntomas con aumento de la movilidad, mejor calidad del sueño y reducción de la medicación analgésica al cabo de 1 mes. Además, la probabilidad de mantener la respuesta analgésica estimada por el método de Kaplan-Meier fue del 53% a los 5 años. La conclusión de los autores es que la radioterapia a dosis bajas mejoró eficazmente el dolor en la zona trocantérea en la mayoría de los pacientes con trocanteritis recurrente, lo que permitió reducir la necesidad de medicación analgésica y, lo que es más importante, mejorar el funcionamiento y la movilidad.
Este es, en mi opinión, el mejor artículo de investigación en Oncología Radioterápica publicado por investigadores españoles en 2022. En este trabajo, los autores comparan los resultados obtenidos en el tratamiento de 487 mujeres con cáncer de mama en estadios iniciales y con baja carga de afectación tumoral ganglionar. Las pacientes con carga tumoral total en el ganglio linfático centinela evaluada por OSNA (One-Step Nucleic Acid Amplification) de 250-15.000 copias mRNA CK19/µL fueron aleatorizadas a recibir irradiación intencional de las áreas ganglionares 1-4 o no, si bien se determinó también la irradiación no intencional que recibieron llas pacientes que fueron aleatorizadas a radioterapia exclusiva de la mama. Con una mediana de seguimiento de 3,7 años, no se observaron diferencias en la supervivencia libre de progresión a 5 años (93,7% vs 93,8%) ni en las tasas de fracaso locorregional (3,5% vs 3,4%). En aquellas pacientes aletaorizadas a no irradiación ganglionar, los niveles 1 y 2 axilares recibieron dosis no intencionales equivalentes al 65% y 43% de las recibidas por las pacientes tratadas de manera intencional, respectivamente.
Este trabajo merece ser considerado el más relevante por muchos y distintos motivos. En primer lugar, por la dificultad que entraña la realización de un ensayo aleatorizado multicéntrico e internacional, con más de 40 centros implicados, para la oncología radioterápica en general, y para la española en particular. La falta de financiación, la falta de equipamientos adecuados cuando se inició el estudio (afortunadamente, hoy ya solventada), la falta de motivación, son argumentos que dan más valor, si puede, a lo conseguido por los investigadores. Pero también porque demuestra las debilidades de los estudios convencionales en Oncología Radioterápica. El lento reclutamiento (cierto que influido también por la pandemia COVID-19) obligó a un cierre prematuro del estudio, algo desgraciadamente no infrecuente en los ensayos de radioterapia. Además, los avances constantes de la radioterapia hacen que el tratamiento que inicialmente se concibió haya quedad ya superado y ni la dosis ni los fraccionamientos sean los considerados estándar hoy, lo que resta valor y aplicabilidad a los resultados finales. En definitiva, un gran trabajo que ha de servir no sólo para analizar sus resultados clínicos sino también para empezar a reconsiderar la manera de hacer estudios en Oncología Radioterápica.
«La ciencia más útil es aquella cuyo fruto es el más comunicable»
Leonardo Da Vinci (1452-1519)